Du kan blive bedt om at skrive elektron konfiguration af et atom på en kemi test, men det er nemmere end det ser ud. Her er hvordan man kommer i gang.
Steps
- 1Bestem antallet af elektroner i atomet. Atomnummer (på den periodiske tabel) er antallet af protoner fra atomet, og således svarer til antallet af elektroner i et atom med nul ladning.
- 2Hvis du arbejder med et opladet atom, tilføje eller fratrække elektroner i overensstemmelse hermed. For eksempel et natrium atom med en negativ ladning ville have en anden elektron foruden atomnummeret af 11, hvilket gør 12 elektroner.
- 3Huske grundlæggende liste over orbitaler. Når du kender rækkefølgen af orbitaler, kan du blot udfylde dem i forhold til antallet af elektroner i atomet.
- Den s orbital sæt (helst tal efterfulgt af et "s") indeholder en enkelt orbital, og ved Paulis udelukkelsesprincip, kan en enkelt orbital holde maksimalt 2 elektroner, så hver s orbital sæt kan holde 2 elektroner.
- Den p orbital Sættet indeholder 3 orbitaler, og dermed kan holde i alt 6 elektroner.
- Den d orbital Sættet indeholder 5 orbitaler, så det kan rumme 10 elektroner.
- Den f orbital Sættet indeholder 7 orbitaler, så det kan holde 14 elektroner.
- Huske rækkefølgen af orbitaler. Bemærk, at orbital sæt er nummereret af elektron skallen, men bestilles i form af energi. For eksempel er en fyldt 4s 2 lavere energi (eller mindre potentielt omskiftelig) end en delvist fyldt eller fyldt 3d 10, så den 4s skallen vises først.
- 4Put en elektron ind i den højeste energi orbital tilgængelige, startende med 1s (rummer højst to elektroner).! Vær forsigtig Fyld ikke orbitaler i den rækkefølge der vises i diagrammet Fyld orbitaler i denne rækkefølge (antallet efter orbital sæt er det maksimale antal elektroner det kan holde!):
- 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6
- Bemærk, at ovenstående liste, hvis alle skaller var fyldt, ville være den elektron konfiguration for Uuo (Ununoctium), 118, det højeste nummererede atom på det periodiske system - så det elektron konfiguration indeholder alle i øjeblikket kendte elektron skallen for opkrævet et neutralt atom.
- Bemærk: Energi niveau ændringer, som du gå op. For eksempel, når du er ved at gå op til 4. energiniveau bliver 4s først, derefter 3d. Efter den fjerde energiniveau, vil du gå videre til den 5., hvor det følger rækkefølgen igen. Dette sker kun efter 3. energiniveau.
- 5Udfylde de orbitaler efter antallet af elektroner i atomet.
Alternativ metode
Der er en alternativ metode til at skrive elektron konfigurationer, kræver hverken udenad, eller huskeregel diagram. Men det kræver omarrangeret periodiske tabel, fordi der i traditionelle periodiske tabel, der begynder med fjerde række, behøver periode numrene ikke svarer til de elektron skaller.
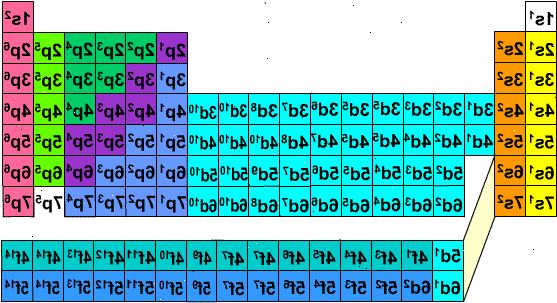
I ADOMAH Periodic Table, designet af V. Tsimmerman repræsenterer vandrette rækker grupper af elementer, såsom halogener, inaktive gasser, alkalimetaller, alkaliske jordarter, osv. Lodrette kolonner svarer til elektron skaller og såkaldte "kaskader" svarer til perioder (når diagonale linjer, der forbinder s, p, d og f blokke følges). Helium er flyttet til brint, da begge er kendetegnet ved de elektroner, der er placeret i den samme orbital. Blokke af perioder (s, p, d og f) er vist på den højre side og shell numre er vist på basen. Elementer bliver præsenteret i rektangulære kasser, der er nummereret 1-120. Disse numre kaldes atomnummer der også repræsenterer det samlede antal elektroner i en neutral atom. Dette arrangement gør skrivning elektron konfigurationer meget enkel:
- 1Print kopi af ADOMAH periodiske tabel fra dette websted: ( www.perfectperiodictable.com/Images/Binder1 ). Hvis du vil skrive elektron konfiguration af et element, skal du finde dens symbol i ADOMAH Periodic Table og strege alle elementer, der har højere atomnummer. For eksempel, hvis du har brug for at skrive elektron konfiguration erbium (68) strege elementer 69 gennem 120. Meddelelse tallene 1 til 8 i bunden af tabellen. Det er elektron shell numre eller kolonne numre. Ignorer kolonner der kun indeholder overstreget elementer. For erbium resterende søjler er 1,2,3,4,5 og 6..
- 2Ser man på de blok, der vises på højre side af bordet (s, p, d, og f), og i kolonnen numrene på basen og ignorerer diagonale linjer mellem blokkene, bryde op kolonner i kolonne-blokke, og liste dem i rækkefølge fra bunden. Igen, ignorere kolonne blokke, hvor alle elementer er overstreget. Skriv ned kolonne-blokke begynder med kolonnen tal efterfulgt af blok symbol, som dette: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (i tilfælde af erbium). Se note nedenfor. *
- 3Tæl elementer, der ikke blev passeret i hver blok-kolonne, og nedskrive deres mængde siden af blok symboler for hver blok kolonne, som dette: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 12 5s 2 5p 6 6s 2. Det er elektron konfiguration af erbium. (Se note nedenfor).
- 4Der er atten almindelige undtagelser elektron konfigurationer til atomer i laveste energitilstand, også kaldet grundtilstanden. De afviger fra den generelle regel kun sidste to-tre elektron positioner. Her er de: Cr (..., 3d5, 4S1), Cu (..., 3d10, 4S1), Nb (..., 4D4, 5S1), Mo (..., 4D5, 5S1), Ru (..., 4d7, 5S1), Rh (..., 4d8, 5S1), Pd (..., 4D10, 5s0), Ag (..., 4D10, 5S1), La (..., 5D1, 6s2), Ce (..., 4F1, 5D1, 6s2), Gd (..., 4f7, 5D1, 6s2) Au (..., 5d10, 6S1), Ac (..., 6d1, 7s2), Th (..., 6D2, 7s2), Pa (..., 5F2, 6d1, 7s2), U (..., 5F3, 6d1, 7s2) Np (..., 5f4, 6d1, 7s2) og Cm (..., 5f7, 6d1, 7s2).
- Bemærk: Ovenstående elektron konfiguration af Er er skrevet i den rækkefølge, opstigende shell numre. Det kunne også være skrevet i størrelsesordenen orbital påfyldning. Bare følg kaskader fra top til bund i stedet for kolonner, når du skriver ned kolonne-blokke: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 12.
Tips
- Der er tilfælde, hvor en elektron skal "fremmes." Når en orbital sæt er en elektron væk fra at være halvt besatte eller helt besat, fjerne en elektron fra den nærmeste s eller p orbital sættet og flytte den til orbital sæt, der har brug elektronen.
- Når atomet er en ion, betyder det, at antallet af protoner ikke lig med antallet af elektroner. Afgiften af atomet, vil dem blive vist øverst til højre (som regel) hjørne af det kemiske symbol. Så en antimon atom med ladning +2 har en elektron konfiguration 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 1.. Bemærk, at 5p 3 ændret til en 5p 1.. Vær forsigtig, når konfigurationen af tomt atom ender i noget, men en s og p orbital sæt. Når du tager væk elektroner, kan du kun tage dem væk fra de Valence orbitaler (s og p orbitaler). Så hvis en konfiguration ender i 4s 2 3d 7 og atomet får en ladning på +2, så konfigurationen ville ændre at ende med 4s 0 3d 7.. Bemærk, at 3d 7 ikke ændrer sig, i stedet er de s orbital elektroner tabt.
- Der er ikke sådan noget som "stabiliteten af en halvfyldt" underniveau. Det er en oversimplificering. Enhver stabilitet vedrørende "halvfyldte" underniveauer skyldes det faktum, at hver orbital enkeltvis er besat, således elektron-elektron repulsioner minimeres.
- Du kan også skrive et element elektron konfiguration ved blot at skrive valens konfiguration, som er den sidste s og p orbital sæt. Så ville valensen konfigurationen af en antimon atom være 5s 2 5p 3.
- At finde atomnummeret af atomet, når det er i elektron konfiguration form bare tilføje op alle de numre, der følger bogstaverne (s, p, d, og f).
- Skrivning lange elektron konfigurationer kan undgås ved at skrive dem i deres ædelgas konfigurationer. Ved hjælp af en elektron konfiguration, der er skrevet i rækkefølge orbital fyldning, finde den sidste symbol indeholdende p6 (såsom 3p 6 eller 5p 6), og tilføje op alle de tal efter bogstaverne i hvert symbol før og inklusive p6 orbital sæt. Derefter bruger summen af tallene, find elementet med den atomnummer lig med summen du lige beregnet. Det skal vises på den meget højre i det periodiske system. Det kaldes en ædel gas. Nu, bare fjerne alle de symboler, som du har tilføjet op og sætte i den ædle gas «symbol i parentes. Så for en antimon atom, ville ædelgas konfigurationen [Kr] 5s 2 4d 10 5p 3.. Bemærk, at du ikke tilføjer op 5s 2 og 4d 10, fordi de er efter 4p 6, som du tilføjer.
- Ioner er ikke den samme. De er meget sværere. Skip to niveauer og følger det samme mønster, afhængigt af hvor du begyndte at afhængigt af hvor højt eller hvor lavt antallet af elektroner, er.
- Hvert atom ønsker at være stabil, og de mest stabile konfigurationer har fuld s og p (S2 og P6) orbital sæt. Ædelgasser har denne konfiguration, hvorfor de er sjældent reaktive og er på den højre side af det periodiske system. Så hvis en konfiguration ender i 3p 4, skal den kun to flere elektroner til at blive stabil (tabe seks, herunder s orbital sæt elektroner, tager mere energi, så mister fire er nemmere). Og hvis en konfiguration ender i 4d 3, skal den kun til at miste tre elektroner for at nå en stabil tilstand. Også halvfyldte skaller (s1, p3, d5..) er mere stabile derefter, for eksempel p4 eller p2, men vil S2 og p6 være endnu mere stabil.
- Der er to forskellige måder at skrive elektron konfigurationer. De kan skrives i den rækkefølge stigende shell tal eller i størrelsesordenen orbital påfyldning, præsenteret som ovenfor for erbium.
- Tallet efter brevet er faktisk hævet, så ikke gøre den fejl på en test.
