Før mashing eller bagning og spise de lækre kartofler i aften, hvad med at bruge dem til at lære lidt om kemiske reaktioner først? Du kan gøre dette ved at opbygge et ur, der kører udelukkende på kartofler. Give det en go, før guffawing!
Steps
- 1Saml krævede elementer. Disse er nævnt nedenfor under "Ting du skal".
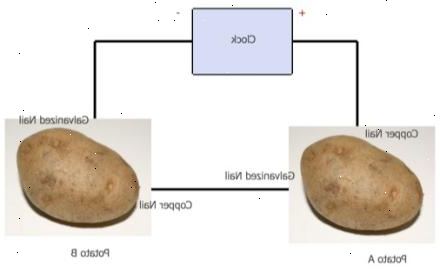
- 2Adskille de to kartofler. Hver kartoffel fungerer som en "galvanisk celle", frigive elektrisk energi gennem kemiske reaktioner. Kalde en kartoffel A (eller 1), og den anden kartoffel B (eller 2).
- Hovedparten af kartoflen blot tjener som en sag for cellen, holde alt i stilling. Kartoffelsaften tjener som "elektrolyt", hvor ladede atomer og molekyler kaldet "ioner" opløses og kan flyde over tid. Den fortyndede phosphorsyre i det giver også hydrogenioner til reaktionen.
- Nogle atomer (eller molekyler) stærkt tiltrækker ekstra elektroner og bliver negativt ladede ioner, kaldet løg ("an-ioner"), andre er let frataget nogle elektroner og bliver positivt ladede "kationer" ("cat-ioner"). Hvert element tiltrækker elektroner med forskellig kraft, på grund af forskellige ladning af protoner, som deres kerne tiltrækker elektroner og den måde, hvorpå de marginale "valens" elektroner arrangere sig omkring kernen og andre elektroner.. Kartoffelsaften har fortyndet phosphorsyre, hvoraf nogle opløser dissocieres til som hydrogenkationer (grundlæggende) og phosphatanioner.
- 3Placer en galvaniseret søm i hver kartoffel.
- 4Placer en søm eller wire stykke til hver kartoffel sikrer, at neglene ikke rører. På dette stadium er det virkelig vigtigt at forstå, at dette eksperiment fungerer kun, hvis de galvaniserede søm og kobber negle / wire er så langt fra hinanden som muligt på kartoffel, fordi afstanden mellem dem er, hvad genererer strøm.
- 5Fjern batteridækslet fra uret. Hvis der allerede er et batteri i det, fjerne det. Tage notits af batteriets polaritet i forhold til, hvordan det forbinder til uret.
- 6Slut den første jumper ledning fra kobber søm eller wire kartoffel A til den positive terminal af uret. For at gøre dette, tage en jumper bly og fastgør alligator klip til kobber søm eller wire og derefter den anden ende er krokodillenæb til den positive terminal (betegnet ved symbolet +).
- 7Tilslut den anden jumper ledning fra galvaniserede søm kartoffel B til den negative terminal af uret, der betegnes med symbolet "-".
- Når man holder zink elektrode (klædningen på den galvaniserede søm) og kobber elektrode (kobber søm eller wire) i kartoffel, hver metal, med mindre elektron affinitet end hydrogenioner, ville have tendens til at have sine atomer frataget deres elektroner fra de hydrogenioner. De neutrale brintatomer ville slutte sig sammen i brint gas molekyler og flygte metalkationerne ville have tendens til at sprede væk og mere brint diffus for at fortsætte reaktionen langsomt boblende væk syren brint og forbruge metallerne.
- Zink har endnu mindre elektron affinitet end kobber. Så hvis du elektroderne tilsluttes med en leder, wiren, vil nogle elektroner tendens til at flyde i det fra zink til kobber.
- Fjernelsen af nogle elektroner fra zink elektrode vil gøre et par af sine atomer falde som kationer og opløses væk. Overskuddet af elektroner på kobber vil gøre brint fortrinsvis tage dem op der, men også en tendens til at gøre kobber holde sine elektroner og ikke være tæret (eller mere præcist, forskyde reaktionsligevægten så kobberioner, der falder off tendens at genvinde elektroner og tilslut for lidt eller ingen netto korrosion). Fjernelsen af elektroner fra kobber og tilsætningen af elektroner til zink vil have en tendens til at opbygge områder af elektrisk ladning, som ville forsinker reaktionen. Men flere elektroner holde ledende gennem ledningen, og mere brint og zink-ioner holde dispergering gennem kartoffel at opretholde frisk opløsning ved hver elektrode, for at holde reaktionen i gang. Den kraft, hvormed kobber trækker således elektronerne kan bruges til at udføre arbejde, ligesom køre et ur..
- 8Slut den tredje jumper ledning til galvaniserede søm kartoffel A. Tilslut derefter den anden ende til kobberet søm kartoffel B. På dette tidspunkt alle tre jumper ledninger er forbundet med hinanden, og uret skal fungere.
- 9Kontroller uret. Det bør nu kører på kartoffel magt.
- Reaktionen forsinker som zink metal og brintioner er opbrugt. Den kraft, hvormed brint trak elektronerne fra zink, i en meget indirekte måde, hvad er cellen stiller til rådighed for dig på arbejde - med lidt bliver "spildt", selvfølgelig.
- Ledningsføring kartoffel celler end-to-end-gør en "serie kredsløb", trækker strømmen af elektroner gennem ur med dobbelt så meget kraft som en kartoffel, der gælder. Det gør dem også korrekt kaldes en "batteri", fordi du bruger mere end en elektrokemisk "celle".
- Når det arbejder, hvorfor så ikke sætte tiden på uret til det aktuelle tidspunkt!
- Hvis uret ikke virker, skal du kontrollere, at alle forbindelser er sikre, og i den rigtige rækkefølge, og dobbelttjekke polariteten af uret. Hvis det stadig ikke virker, kan dit ur kræver mere strøm end meget lidt en grøntsag batteri kan levere. Du kan tilfredsstille dig selv, at batteriet er at producere nogle el med en og måle dens spænding (elektrisk tryk) og strøm (elektrisk strøm, ampere). Hvis du nødt til at vælge skalaer vælger meget lave dem: disse batterier producere en volt eller to og et par milliampere.
Tips
- Du kan købe en kartoffel ur kit. Billigere dem bare have et ur, der sættes i kartoflerne med ledninger og elektroder, dyrere dem holde kartoflerne i en integreret samling med kopper.
- Det er ikke kun kartofler, du kan gøre dette med. Prøv med andre frugter og grøntsager, som citrusfrugter, avocado, bananer, osv. Det vil endda arbejder i soda.
- Israelske forskere har fundet, at de kan producere op til 10 gange for strømmen, når kartoflen er kogt.
- En citron batteri fungerer omtrent på samme måde, men med citronsyre snarere end phosphorsyre levere de hydrogenioner. Andre typer batterier på samme måde tillade dig at udnytte energien af elektroner 'flow fra et område, hvor de er lettere gives op til, hvor de er lettere accepteret, men adskiller sig i mange detaljer.
- Fænomenet med de ekstra elektroner Holde kobber fra corroding kan være nyttigt, også. Hvis det er dit mål, er du siges at være ved hjælp af "katodisk beskyttelse" snarere end at gøre et batteri. En billig bid af reaktivt metal, ligesom zink eller magnesium, korroderer kan selv væk og genopbygge elektroner til at beskytte en værdifuld struktur af mindre reaktive metaller, ligesom en bro eller et skib. (Vand er ikke nær så reaktiv som batterisyre, så den reaktive metal varer et stykke tid, selv med nogen modstand mod strømmen i lederen.) For en enorm struktur, kunne man bruge jævnstrøm "påtrykt strøm" fra en on -site generator eller line effekt (med en professionelt designet maskine - el og vand kan være farligt).
- Uret er sandsynligvis en quartz ur, som gælder el til en lille kvarts krystal stemmegaffel til fysisk "ring" det på sin resonansfrekvens. Gaflen giver tilbage et elektrisk signal med hver vibration. Andre dele elektronisk tælle vibrationerne, beregne den tilsvarende tid, og arrangere krystallerne i displayet for at vise det frem.
Advarsler
- Små børn skal være under opsyn, når du udfører dette eksperiment - negle og ledninger er skarpe og kan forårsage personskade, hvis de håndteres forkert. Fjernelse af batterier bør også være under opsyn.
- Spis ikke kartoflerne bagefter.
Ting du behøver
- 2 store rene kartofler, eller 2 halvdele af en stor kartoffel.
- 2 galvaniserede søm (zink)
- 2 kobber søm eller ledninger
- 3 jumperledninger (med krokodillenæb i hver ende)
- Batteridrevet LCD ur (grå skærm med sorte tal, som en billig ur, der normalt tager bare en 1.5V batteri)
